Hace mucho tiempo, la única forma de obtener energía portátil era el vapor o el combustible. Tras la invención de la batería, la vida se ha vuelto más fácil que nunca. Hoy en día, todo el mundo busca máquinas portátiles para facilitar sus tareas cotidianas. En ese caso, las pilas son capaces de satisfacer la necesidad de producir energía sobre la marcha.
Sin duda, las pilas parecen bastante pequeñas y aburridas, pero son capaces de convertir un pequeño cilindro en tu propia microcentral eléctrica. La idea de generar energía portátil no es nada nuevo, ya que incluso los humanos prehistóricos la producían utilizando maderas y combustibles. Lo que ocurre es que las pilas son una fuente de energía instantánea. Basta con pulsar un botón para que el cuarto oscuro se ilumine en un segundo o incluso menos.
Existen varios tipos de pilas en el mercado. Todas ellas funcionan según el mismo principio de convertir la energía química en energía eléctrica. En este artículo vamos a explicarte todo lo que necesitas saber sobre los distintos tipos de pilas, su funcionamiento y su uso.
Antes de empezar con el funcionamiento y los tipos de pilas, vamos a echar un vistazo a su historia. ¿De dónde vienen? Y quién las descubrió.

Historia de las Baterías
En 1800, Volta descubrió que ciertos fluidos pueden generar energía eléctrica continua cuando se utilizan como conductores. Este descubrimiento dio lugar a la primera célula voltaica llamada pila. La invención de la pila por Volta inició una nueva era de experimentación con pilas.
Numerosos científicos realizaron diversos experimentos para fabricar pilas. Pero apenas unos pocos fueron capaces de obtener alguna conclusión. Volta y Daniel fueron dos científicos que fabricaron pilas conocidas como Voltaica y Daniel respectivamente.
Célula Voltaica: Las células voltaicas utilizan reacciones químicas para producir energía eléctrica.El ánodo y el cátodo están situados uno frente al otro. La oxidación se produce en los ánodos y la reducción en los cátodos.
Se crea un puente de sal entre ambos para completar el circuito. Las partes donde se produce la oxidación y la reducción se denominan semicélulas. Se utiliza un circuito externo para conducir el flujo de electrones.
La célula voltaica inventada por Volta no era muy portátil y además tenía demasiadas desventajas. Posteriormente, se popularizó la célula de Daniel diseñada por «John Fredric Daniel».
Célula Daniel: Tras la invención de la célula voltaica, la célula Daniel fue popular en siglos anteriores como fuente de electricidad. En este tipo de célula, un recipiente se dividía en dos compartimentos. La separación se realizaba mediante una membrana permeable a los iones.
En uno de los componentes, se sumergía un electrolito de Zinc en una solución de sulfato de Zinc. En el otro compartimento, se sumergía un electrodo de cobre en una solución de sulfato de cobre. La célula era capaz de suministrar corriente hasta que se agotaba el sulfato de Zinc o de Cobre.
John Dancer llevó adelante este experimento y diseñó la primera pila con diseño poroso.
En 1859, la pila de plomo-ácido diseñada por Gaston Plante se hizo popular gracias a su función recargable. Su sencillo diseño permitía recargar invirtiendo el flujo de corriente hacia la batería. Esta pila se sigue utilizando en muchos lugares, como baterías de coches, vehículos de motor, etc.
Además, la pila Leclanche fue inventada por Carl Gessner como diseño seco que no tenía ningún electrolito líquido.
Echemos un vistazo a la pila de Leclanche.
![Batería de Leclanche [Tipos de pilas]](https://sobre-tecnologia.com/wp-content/uploads/2022/12/Foto-2-2.webp)
Este invento hizo que el uso de la pila fuera muy fácil y cómodo, ya que se erradicaron totalmente los problemas de derrame y orientación. De nuevo se inventó la pila de níquel-cadmio, comúnmente conocida como pila alcalina. En la década de 1970 se inventaron la mayoría de las pilas de litio para su uso en dispositivos portátiles.
Química general de la batería:
Una batería tiene tres capas: el cátodo, el ánodo y un separador. La capa negativa de la pila se denomina ánodo y la capa positiva cátodo. Cuando se conecta una carga a la batería, la corriente empieza a fluir a través del ánodo hacia el cátodo. Del mismo modo, cuando conectamos el cargador de la batería, la corriente comienza a fluir en la dirección opuesta, es decir, del cátodo al ánodo.
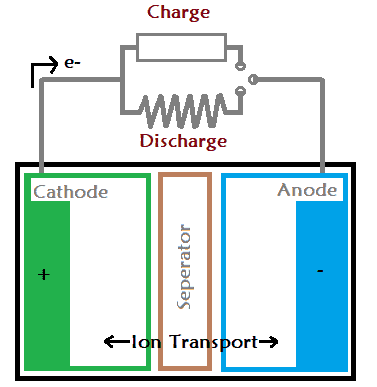
Todas las baterías funcionan con una reacción química llamada reacción de oxidación-reducción. Este tipo de reacción química tiene lugar entre el cátodo y el ánodo a través del electrolito.
Como resultado, un electrodo se carga negativamente debido a la reacción de oxidación. Este electrodo cargado negativamente se denomina cátodo. El segundo electrodo se carga positivamente debido a la reacción de reducción y se denomina ánodo. Cuando dos metales diferentes se sumergen en la misma solución electrolítica, uno de los electrodos gana electrones y el otro los pierde.
En consecuencia, uno de los metales perderá electrones y el otro los ganará. La diferencia de potencial entre los metales está producida por la diferencia de electrones que hay entre los dos metales. Esta diferencia de potencial puede utilizarse como fuente de tensión en cualquier dispositivo eléctrico.
Los iones sólo fluyen a través del separador, que bloquea todo el movimiento del ánodo al cátodo. Por lo tanto, la única forma de sacar la corriente es desde los terminales de la pila.
Veamos cómo se clasifican las pilas…
Tipos de Pilas
Las pilas se utilizan tanto en aparatos domésticos como en aplicaciones industriales. Cada pila está diseñada para cumplir una función específica y puede utilizarse en función de las necesidades. Existen principalmente dos categorías de pilas: primarias y secundarias.
Sin embargo, las pilas se clasifican en cuatro grandes categorías: pilas primarias, pilas secundarias, pilas de combustible y pilas de reserva. A continuación encontrará todo lo que necesita saber sobre los distintos tipos de pilas y su funcionamiento.
- Pilas primaria
- Pilas secundaria
- Célula de reserva
- Pilas de combustible
Pilas primarias (Baterías no recargables)
Las pilas no recargables también se conocen como pilas primarias o pilas primarias. Las pilas primarias son aquellas que no pueden volver a utilizarse una vez que su energía almacenada se ha utilizado por completo. Estas pilas no pueden recuperar la energía mediante ninguna fuente externa. Esta es la razón por la que las pilas primarias también se denominan pilas desechables.

Un factor importante que reduce la vida útil de las pilas primarias es que se polarizan durante su uso. Para prolongar la vida útil de la pila reduciendo el efecto de la polarización, se utiliza la despolarización química, es decir, la oxidación del hidrógeno a agua mediante la adición de un agente oxidante a la pila. Por ejemplo, en la pila de zinc-carbono y la pila Leclanche se utiliza dióxido de manganeso, y en la pila Bunsen y la pila Grove se utiliza ácido nítrico.
Aplicaciones de las pilas primarias:
- Se pueden utilizar en relojes y juguetes
- Se puede utilizar en pequeños aparatos domésticos
- En ordenadores personales
- Se puede utilizar en luces de emergencia portátiles e inversores
Las pilas no recargables son de muchos tipos. Son los siguientes:
- Pila de zinc-carbono (también conocida como «Heavy Duty»)
- Alcalinas
- Pilas de litio
- Pilas de óxido de plata
- Pilas de zinc-aire
- Pilas de Zinc-Carbono
Las pilas de zinc-carbono son las primeras pilas secas comerciales que proporcionan una potencia muy baja y también se conocen como pilas secas. En la pila se coloca una varilla de carbono que recoge la corriente del electrodo de dióxido de manganeso.
Puede suministrar 1,5 Voltios de corriente continua. Este tipo de pilas se utilizan en linternas, radios, mandos a distancia y relojes de pared.

- Alcalinas
La alcalina es también una pila seca, compuesta por un ánodo de zinc y un cátodo de dióxido de manganeso. La pila alcalina está envasada en una lata de acero y la región interior más externa está llena de dióxido de manganeso.
El zinc y el electrolito de hidróxido de potasio se encuentran en la parte central de la pila. Las pilas alcalinas tienen mayor densidad que las demás. Suelen utilizarse en reproductores de audio, radios y linternas.
- Pilas de Litio
Las pilas de litio se presentan en forma de moneda o de botón. Proporcionan un voltaje más alto (3V) que las pilas de zinc, alcalinas y de manganeso. Las pilas de litio son más pequeñas y ligeras. La resistencia interna de las pilas de litio es alta y no son recargables.
La pila monedero más utilizada en numerosas aplicaciones electrónicas es la CR2032, que proporciona una salida de 3V. Las pilas de litio tienen una vida útil más larga (unos 10 años).
- Pilas de Óxido de Plata
Las pilas de óxido de plata son pilas de baja potencia y gran capacidad. Su aspecto es similar al de las pilas de mercurio y proporcionan una emf superior de 1,5 voltios. El cátodo de la pila está formado por óxido de plata. El electrolito presente en el interior de la pila es hidróxido de potasio o de sodio. Como la plata es cara, esta pila tiene aplicaciones muy limitadas.
Las excelentes características de las pilas de óxido de plata son:
- El sellado único de la estructura de la pila la hace altamente estanca.
- La salida de tensión constante que proporciona la pila hace que sea útil para obtener una descarga estable.
- El uso de antioxidantes contribuye a la alta densidad energética de la pila.
Aplicaciones de las células de óxido de plata:
- Dispositivos basados en IoT
- Relojes eléctricos
- Instrumentos de precisión
- Dispositivos médicos
- Pilas de Zinc-Aire
Una pila de zinc-aire alcanza tensiones operativas plenas en 5 minutos justo después de desprecintar. Se trata de pilas primarias con diseño recargable. El contenido de oxígeno del aire actúa como masa activa de la pila. El cátodo es un cuerpo poroso formado por carbono con acceso de aire.
La capacidad de tensión de salida de la pila es de 1,65 voltios. Durante la descarga, una masa de partículas de zinc forma un ánodo poroso saturado de un electrolito. El oxígeno presente en el aire reacciona con el ion hidroxilo y forma zincato. Este zincato forma óxido de zinc y el agua vuelve al electrolito.
Pilas secundarias (Baterías recargables)
Las pilas recargables también se conocen como pilas secundarias. Se pueden utilizar una y otra vez conectándose a la carga y obtener múltiples usos antes de que sea necesario sustituir la pila.
El coste inicial de las pilas recargables suele ser mayor que el de las pilas desechables, pero el coste total de propiedad y el impacto medioambiental de estas pilas son menores porque pueden recargarse de forma económica muchas veces antes de que sea necesario sustituirlas.
Aplicaciones de las Pilas Secundarias
- Puede utilizarse en pulseras de fitness y relojes inteligentes.
- Puede ser utilizado en militares y submarinos
- Cámaras y marcapasos artificiales
Las baterías recargables o secundarias son principalmente de tres tipos:
- Plomo-ácido
- Ión de litio (Li-ion)
- Níquel Metal Hidruro (Ni-MH)
- Níquel Cadmio (Ni-Cd)
- Plomo – Ácido
El plomo-ácido es un tipo muy común de batería recargable. Suelen utilizarse para almacenar energía solar porque su calidad las diferencia de las demás. Estas baterías proporcionan una corriente elevada y se utilizan en vehículos.
Cuando la batería deja de funcionar, se puede reciclar. Alrededor del 93% del plomo de las baterías se reutiliza para fabricar nuevas baterías de plomo-ácido.

- Ión de Litio (Li-ion)
Las baterías de iones de litio son baterías recargables, también conocidas como baterías de iones de litio. Estas baterías se utilizan habitualmente en electrónica, ya que tienen una gran densidad de potencia.
Estas baterías pueden almacenar 150 vatios-hora por kilogramo. En el proceso de descarga, los iones de litio se desplazan del electrodo negativo al positivo y viceversa. El sobrecalentamiento puede dañar la batería o provocar un incendio.

- Hidruro metálico de níquel (Ni-MH)
Las pilas de níquel-hidruro metálico son pilas recargables. El metal de la pila es intermetálico. Este tipo de pilas tiene una buena duración y una gran capacidad de corriente. Pueden almacenar 100 vatios-hora por kg. Térmicamente estas baterías son más estables que las de iones de litio. La autodescarga es mayor que la de las otras baterías.

- Níquel Cadmio (Ni-Cd)
En la pila recargable de Níquel-Cadmio se utilizan como electrodos el hidróxido de óxido de níquel y el cadmio metálico. También se conoce como pila de NiCd o pila de Ni-Cad. Las pilas de Ni-Cd son buenas para mantener el voltaje y conservar la carga eléctrica cuando no se utilizan.
Uno de los inconvenientes más relevantes de las pilas de Ni-Cd y que puede reducir su capacidad futura, es que si se recarga una pila parcialmente cargada, puede ser víctima del “efecto memoria» (es decir, cambios en la placa negativa o de cadmio, por ejemplo, la carga implica la conversión de CD(OH) en Cd metal) y la caída de tensión.

Las pilas de níquel-cadmio ofrecen una buena capacidad nominal a plena velocidad de descarga y un buen ciclo de vida en operaciones a baja temperatura.
Diferencia entre Pilas Primarias y Pilas Secundarias
Especificaciones:
Las pilas primarias tienen una alta resistencia interna, mayor capacidad y un diseño más pequeño. Las células secundarias tienen una resistencia interna baja, reacciones químicas reversibles y un diseño complejo.
Diseño:
Las pilas primarias suelen ser pilas secas. Es decir, no tienen fluido y están llenas de pasta que permite el movimiento de iones dentro de la batería. Esta es la razón por la que las pilas primarias son resistentes a los derrames. Sin embargo, las pilas secundarias están compuestas de líquido o sal fundida.
Para que pueda comparar mejor las pilas primarias y secundarias, sus ventajas y desventajas, hemos resumido las diferencias en la siguiente tabla:
| Pilas Primarias | Pilas Secundarias |
| Adecuadas para aplicaciones portátiles debido a su peso ligero y diseño más pequeño | No apto para dispositivos portátiles |
| Buena retención de carga | Retención de carga inferior |
| No son adecuadas para aplicaciones de alto coste | Muy recomendable para aplicaciones de copia de seguridad y de alto coste |
| Limitadas a aplicaciones específicas | Muy versátil, por lo que tiene un amplio espectro de aplicaciones |
| Bajo coste inicial | Mayor coste inicial |
Después de revisar la tabla anterior, espero que ahora seas capaz de averiguar los pros y los contras de las pilas primarias y secundarias.
Célula de Reserva
Las baterías o pilas de reserva también se conocen como batería de reserva. El electrolito permanece inactivo en estado sólido hasta que se alcanza el punto de fusión. En cuanto se alcanza el punto de fusión, comienza la conducción iónica y se activa la batería.
Las pilas de reserva se clasifican a su vez en tres categorías:
- Pilas activadas por agua
- Pilas activadas por calor
- Pilas activadas por electrolitos
- Baterías activadas por gas
Aplicaciones de las pilas de reserva:
- Se utilizan en dispositivos de detección de tiempo y presión
- Se utilizan en gran medida en sistemas de armamento
- También se utilizan en baterías de automóviles y otros vehículos
Pilas de Combustibles
En esta clase de pilas, los materiales activos se alimentan de una fuente exterior. Las pilas de combustible son capaces de producir energía eléctrica siempre que se alimenten los electrodos con materiales activos. La membrana de intercambio protónico utiliza gas hidrógeno y oxígeno como combustible.
La reacción tiene lugar dentro de la célula y como producto de la reacción se produce agua, electricidad y calor. Los elementos elementales de las pilas de combustible son el ánodo, el cátodo, el electrolito y el catalizador.
Ventajas de la tecnología de la pila de combustible:
- El proceso de convertir la energía potencial química directamente en energía eléctrica evita el «cuello de botella térmico».
- Al no tener piezas móviles, la pila es cómoda y muy fiable.
- Debido a la producción de hidrógeno de forma respetuosa con el medio ambiente, es comparativamente menos dañina para el medio ambiente que otras.
Aplicaciones de la pila de combustible
- Se utiliza principalmente en transportes como coches, autobuses y otros vehículos de motor.
- Se utiliza muy a menudo como reserva para producir electricidad en caso de corte de suministro.
Ventajas de la batería sobre otras fuentes de energía
- Capacidad de energía específica: La capacidad de almacenamiento de energía de la batería es muy inferior a la del combustible fósil. Sin embargo, las baterías tienen la capacidad de suministrar energía de forma más eficaz que los motores térmicos.
- Ancho de banda de potencia: las baterías son capaces de gestionar cargas pequeñas y grandes con mayor eficacia gracias a su gran ancho de banda de potencia.
- Capacidad de respuesta: Las baterías son capaces de suministrar energía a corto plazo. Esto significa que no es necesario un calentamiento como en el caso de los motores de combustión.
- Medio ambiente: Las baterías son fáciles de usar y se mantienen razonablemente frías. La mayoría de las baterías no hacen ruido como en el caso de otros motores de combustible.
- Instalación: Hoy en día, las baterías selladas pueden funcionar en casi cualquier posición. Toleran bien los golpes y las vibraciones.
Inconvenientes de las pilas
- Tiempo de carga: Una vez que las pilas se descargan, tardan horas en volver a recargarse para su uso. Esto no ocurre en el caso del uso de combustibles, que tarda unos minutos.
- Coste de funcionamiento: El precio y el peso de las baterías grandes las hacen poco prácticas para el uso fiable y los vehículos grandes.
- Capacidad de almacenamiento de energía: En comparación con los combustibles fósiles, la capacidad de almacenamiento de energía de las baterías es baja.
¿Cómo elegir la batería adecuada para su aplicación?
Es muy importante elegir la batería adecuada para su aplicación para evitar daños en el dispositivo o la aplicación. A continuación se indican algunas de las consideraciones que deben tenerse en cuenta al elegir la batería adecuada para su aplicación.
Primaria o secundaria: Este es uno de los factores más importantes a la hora de elegir el tipo de batería adecuado para tu dispositivo. Puedes utilizar la pila primaria para un uso ocasional y en dispositivos desechables como juguetes, etc.
Sin embargo, si vas a utilizar el dispositivo durante largos periodos de tiempo, las pilas secundarias o recargables son más adecuadas.
Rango de temperatura: Elegir una batería con la temperatura adecuada ayuda a reducir el riesgo de fuga térmica. Las baterías de iones de litio pueden cargarse dentro de un estrecho rango de temperaturas de entre 20 y 45 grados centígrados.
La explosión de las baterías puede producirse como resultado de una sobrecarga, una carga a alta temperatura o un cortocircuito que acabe dañando el dispositivo o la aplicación.
Durabilidad: La durabilidad de la batería depende en gran medida de dos factores: la duración de la carga y la duración total. Además, los factores físicos de la batería también contribuyen a su larga duración.
Densidad energética: La cantidad total de energía almacenada en la batería por unidad de volumen se denomina densidad de energía. Define la estabilidad de la batería, es decir, cuánto tiempo funcionará hasta la siguiente recarga.
Seguridad: La batería que elijas debe estar de acuerdo con la temperatura de funcionamiento de la misma. A veces, si la temperatura de la batería es excesiva, puede dañar los componentes del dispositivo. En el caso de que la temperatura del dispositivo se exceda el rendimiento puede reducirse.
Los otros factores incluyen:
- Química celular
- El transporte
- Forma y tamaño físicos
- El coste
- Fiabilidad
Batería de los vehículos eléctricos
Las baterías de los vehículos eléctricos están diseñadas para suministrar energía durante un periodo de tiempo prolongado. Los factores que las diferencian de las demás baterías son el encendido y la iluminación. Las baterías para vehículos eléctricos están aumentando su cuota de mercado debido a su fiabilidad y su naturaleza respetuosa con el medio ambiente.

Las baterías más comunes en los coches modernos son las de iones de litio y las de polímero de litio. Las celdas se instalan en forma de módulos. En otras palabras, se instala una forma de batería para formar un paquete. Tomemos como ejemplo el coche eléctrico BMW, en el que se instalan un total de 96 celdas. El número de celdas se coloca en un marco que protege las baterías del calor externo y las vibraciones. Una combinación de celdas se denomina módulo.
Varios módulos de este tipo, un pack de refrigeración y un sistema de gestión de la batería se combinan para formar un pack.
Los dos tipos principales de baterías de iones de litio que se utilizan en los vehículos eléctricos son:
- Meta óxidos
- Fosfato
En aplicaciones de automoción como los vehículos, las baterías de iones de litio son más seguras en términos de riesgo químico y comodidad.
Construcción de baterías para Vehículos Eléctricos
Actualmente, los coches eléctricos funcionan con baterías de litio. El voltaje normal de una célula de litio es de 3,7 voltios, pero un VE (vehículo eléctrico) requiere 300V. Para alcanzar este valor de tensión y corriente, las células de litio se combinan en serie y en paralelo. La combinación de estas células de litio se conoce como módulo. Los módulos vienen con un BMS (sistema de gestión de la batería) para su protección. A continuación se muestra la imagen del Nissan Leaf, que muestra los módulos de celdas de litio creados para alcanzar el voltaje requerido.

Instrucciones importantes para el uso de baterías de vehículos eléctricos
- No dejes que la batería llegue por debajo de la tensión de corte, lo que también se denomina sobredescarga.
- La máxima eficiencia sólo puede alcanzarse cuando los valores nominales de corriente son más bajos.
- Las baterías de los vehículos eléctricos vienen en KWH (Kilo vatio hora) de clasificación, que define que el tiempo de la batería del vehículo funcionará.
- Las baterías siempre se autodescargan.
- El sistema de gestión de baterías (BMS) le ayuda a conocer la carga restante de la batería.


También puede interesarte alguna de las siguientes entradas
Calculadora LEY DE OHM
¿Cuál es el origen de la energía eléctrica? Descubre su fascinante historia
¿Qué cable lleva la corriente, la fase o el neutro? Descúbrelo aquí!
¿Cuál es la intensidad de un LED? Guía completa para entender y aprovechar al máximo la iluminación LED
¿Qué elementos transforman la energía? Descubre cómo funciona la transformación de energía
¿Cómo se mueven las cargas en un circuito?
¿Cuál es la diferencia entre la potencia y la resistencia?
Diferencia entre voltaje y amperaje: Todo lo que necesitas saber
¿Cómo comprobar una batería de coche con Tester Meter?
Cómo probar un diodo con un multímetro digital y analógico – 4 maneras
¿Qué sucede si conectamos un condensador polar de forma incorrecta?
¿Por qué un condensador bloquea la corriente continua pero deja pasar la corriente alterna?
Suscríbete a Sobre-Tecnología